Microbiota e tumore al colon

Abbiamo visto come il microbiota intestinale sia implicato nell’insorgenza, nell’esacerbazione o, al contrario, nella remissione dei sintomi di diverse patologie, sia intestinali che sistemiche. Detto questo, una domanda sorge spontanea: il microbiota potrebbe avere un ruolo nell’insorgenza di una delle patologie più gravi che colpiscono il tessuto intestinale, ossia il tumore al colon-retto?
Questo tipo di tumore è il secondo in Italia tra quelli più frequentemente diagnosticati (il primo è il tumore al seno) e, purtroppo, sempre il secondo come causa di morte (il primo è quello al polmone). E’ più frequente negli uomini che nelle donne (1 caso su 13 rispetto ad 1 su 21) ma negli ultimi anni si sta fortunatamente assistendo ad una riduzione dei casi per entrambi i sessi.
Dato l’impatto di questa neoplasia, le ricerche su di essa e sull’ambiente che la circonda sono molto approfondite: ne deriva che anche l’associazione microbiota-tumore al colon sia molto studiata.
Causa o effetto?
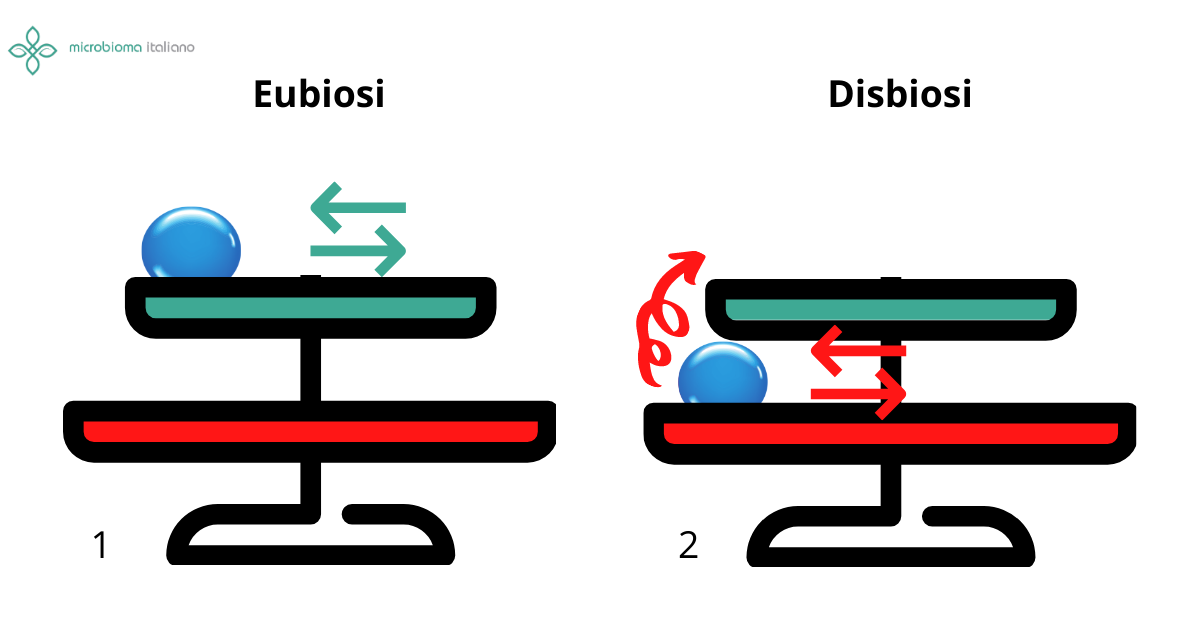
Come per le altre patologie che dipendono da un mix di genetica, ambiente, fattori endogeni e microbiota, capire se un microbiota sbilanciato sia una causa o una conseguenza della malattia non è per niente facile. Infatti i meccanismi con cui un microbiota sbilanciato potrebbe influire sull’insorgenza del tumore al colon sono diversi anche se non ancora del tutto chiariti. Una prima attività pro-oncogenica riguarderebbe i metaboliti prodotti dal microbiota: molecole infiammatorie, ossidanti o tossiche per le cellule che potrebbero danneggiarsi e mutare. In secondo luogo un microbiota patogenico potrebbe legarsi alle cellule, invadere il tessuto e traslocare fuori dal lume intestinale. In questa area potrebbe attivare il sistema immunitario che a sua volta danneggerebbe il tessuto e così via. Ma tutti i batteri patogeni e tutte le disbiosi possono aumentare il rischio di cancro al colon?
Alcuni dei colpevoli sono noti
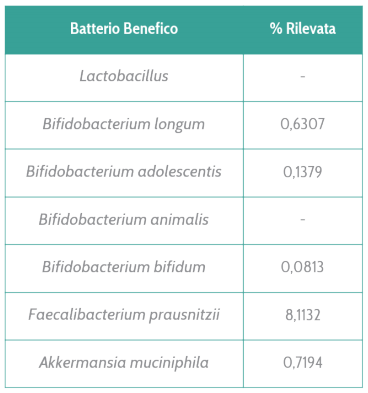
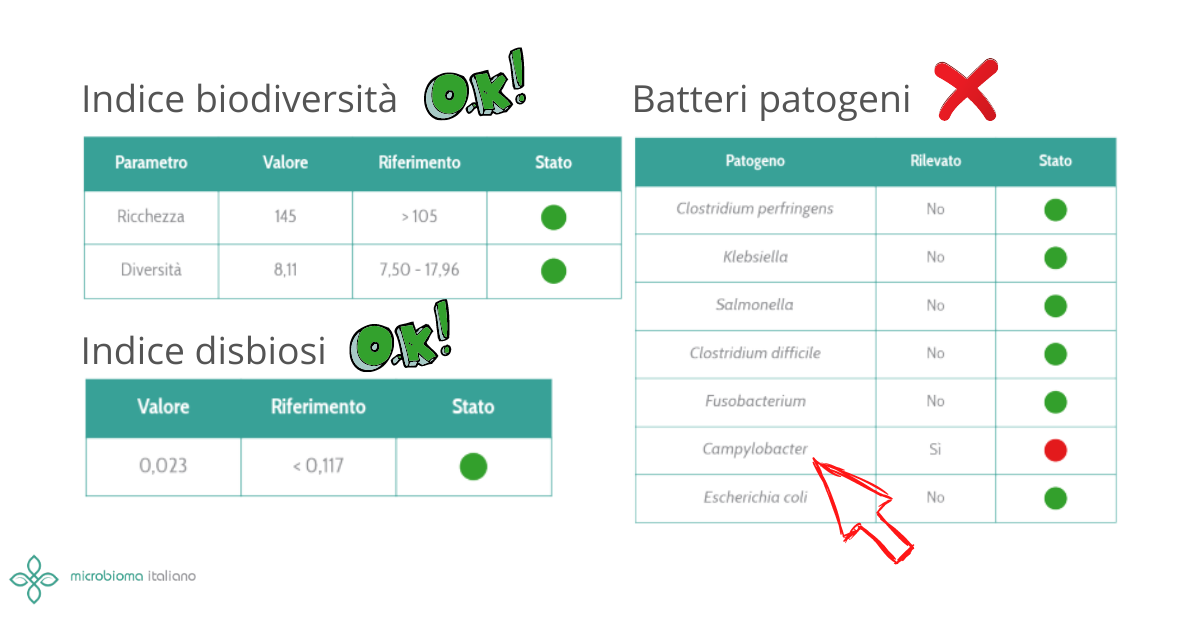
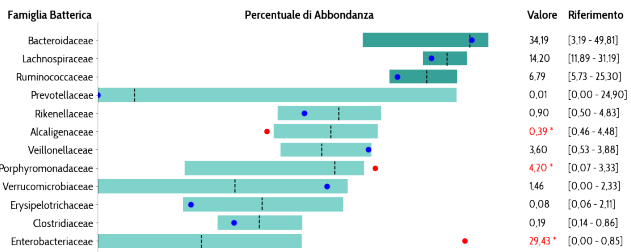
All’interno di un microbiota sbilanciato, alcuni indiziati batterici sono particolarmente noti ai ricercatori. Tra questi il famoso Fusobacterium nucleatum è il batterio più comunemente presente in casi di tumore al colon e pertanto ormai è considerato quasi un marcatore di patologia. È un batterio pro-infiammatorio e la sua presenza (associata ad altri fattori di rischio genetici) aiuta a far proliferare le cellule neoplastiche e a inibire una difesa immunitaria anti tumorale. Non è comunque l’unico. Le Peptostreptococcaceae, E. coli tossigenico, persino batteri orali come la Porphyromonas gingivalis sono spesso correlati con l’insorgenza del tumore al colon.
Stile di vita e alimentazione prima difesa
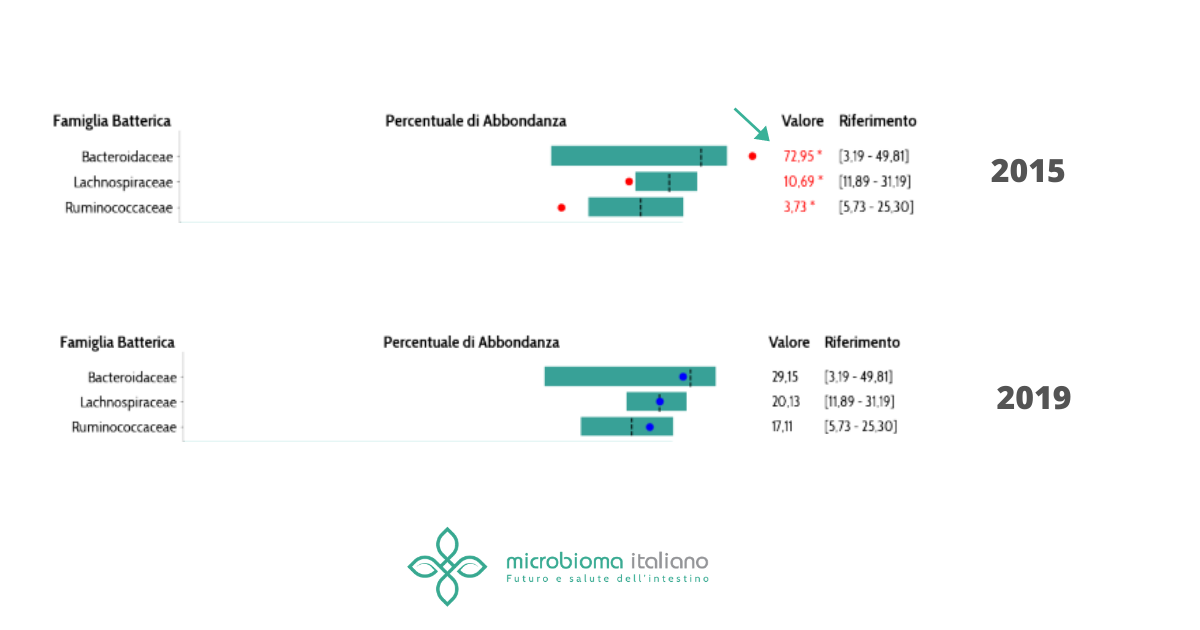
Possedere tali batteri nel proprio microbiota intestinale tuttavia non implica che la patologia insorga necessariamente. Sono un fattore di rischio ma, come ben sappiamo, un microbiota disbiotico può essere modulato tramite uno stile di vita attivo e un’alimentazione sana. Infatti, diversi studi hanno dimostrato che uno stile di vita poco attivo e un indice di massa corporea alto sono altamente correlati all’insorgenza del tumore al colon. Tali fattori di rischio tendono a promuovere uno stato infiammatorio e ad impoverire il microbiota di batteri produttori dei benefici acidi grassi a corta catena. Al contrario uno stile di vita attivo, un basso indice di massa grassa e sicuramente un’alimentazione bilanciata, ricca in fibre (frutta, verdura, grani) e grassi buoni (pesce, grassi vegetali) promuovono la crescita di batteri benefici e proteggono dall’insorgenza del tumore al colon (come di molti altri tumori).
Non possiamo cambiare i nostri geni ma possiamo aiutarli con diverse strategie, a partire dalle scelte che facciamo a tavola e di conseguenza da come trattiamo il nostro piccolo grande tesoro batterico che abbiamo in pancia.
La ricerca ci sta aiutando a capire come fare. Aiutiamo la ricerca.
Alla prossima!
Eleonora Sattin, PhD
P.S.
Visitate l’iniziativa del collega bioinformatico Dr. Benvenuto per sostenere la raccolta fondi AIRC al seguente link.
https://www.epicentro.iss.it/tumori/pdf/NC2019-operatori-web.pdf
Dominik Ternes, Jessica Karta, Mina Tsenkova, Paul Wilmes, Serge Haan, Elisabeth Letellier.
Microbiome in Colorectal Cancer: How to Get from Meta-omics to Mechanism? (2020) Trends in Microbiology DOI:https://doi.org/10.1016/j.tim.2020.01.001
Song M, Chan AT, Sun J. Influence of the Gut Microbiome, Diet, and Environment on Risk of Colorectal Cancer. Gastroenterology. 2020 Jan;158(2):322-340. doi: 10.1053/j.gastro.2019.06.048. Epub 2019 Oct 3. PMID: 31586566; PMCID: PMC6957737.
De Almeida, C. V., de Camargo, M. R., Russo, E., & Amedei, A. (2019). Role of diet and gut microbiota on colorectal cancer immunomodulation. World journal of gastroenterology, 25(2), 151–162. https://doi.org/10.3748/wjg.v25.i2.151
Sánchez-Alcoholado, L., Ramos-Molina, B., Otero, A., Laborda-Illanes, A., Ordóñez, R., Medina, J. A., Gómez-Millán, J., & Queipo-Ortuño, M. I. (2020). The Role of the Gut Microbiome in Colorectal Cancer Development and Therapy Response. Cancers, 12(6), 1406. https://doi.org/10.3390/cancers12061406












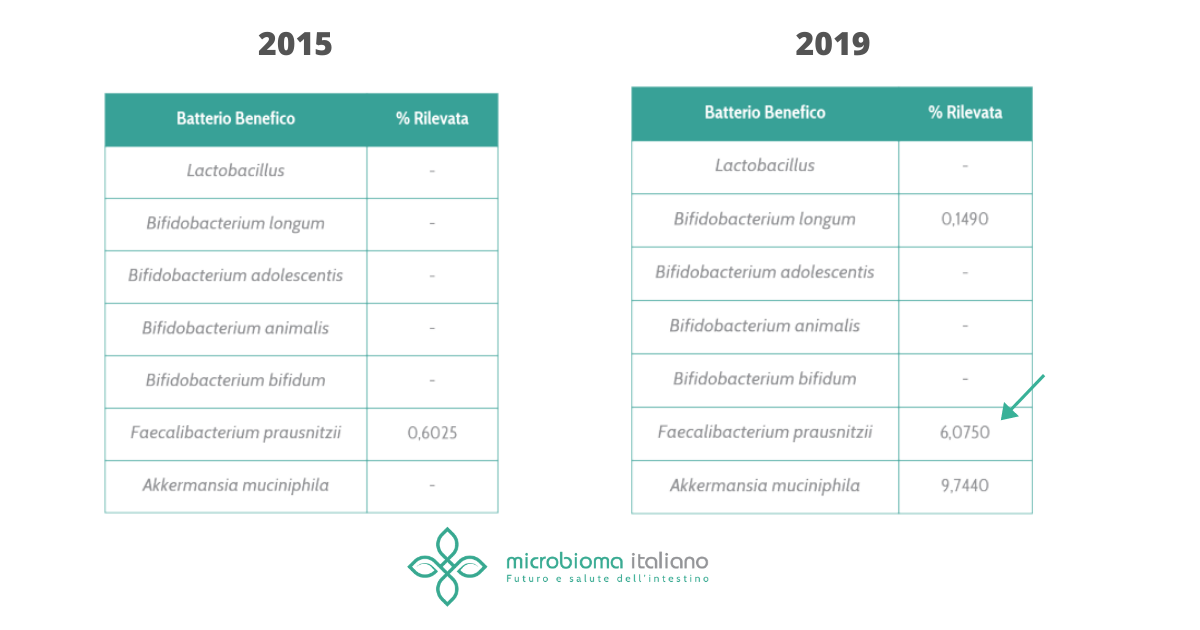
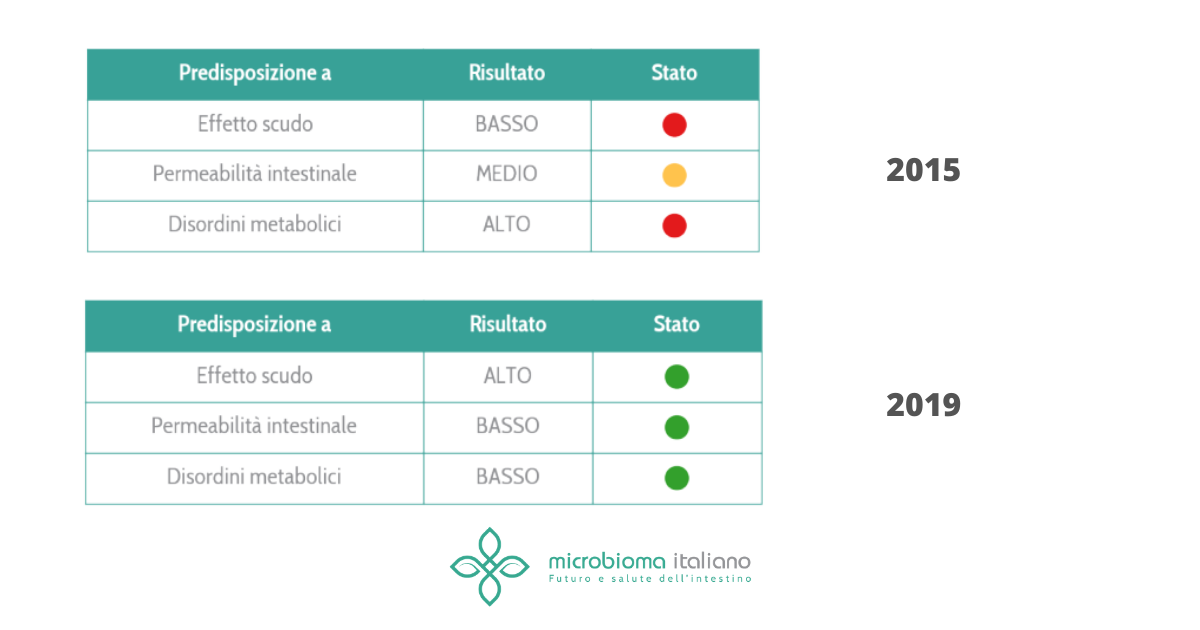


 Era nell’aria già da un po’. Ma d’altronde come poteva non essere così?
Era nell’aria già da un po’. Ma d’altronde come poteva non essere così?