Batteri del buonumore? Esistono e sono farmaci viventi
Vi siete mai sentiti arrabbiati, tristi, ansiosi oppure anche solo stanchi e svogliati dopo una terapia antibiotica? Tranquilli, è tutto normale. Questa reazione è solo uno dei diversi modi con cui il microbiota fa sentire che c’è e che ha qualcosa da ridire. Sì, perché se da una parte gli antibiotici sono fondamentali per curare un’infezione batterica, dall’altra possono colpire anche batteri intestinali benefici. Infatti se si assumono i cosiddetti antibiotici “ad ampio spettro”, ovvero non specifici per un determinato gruppo di microrganismi, questi farmaci uccidono un po’ tutti i batteri sensibili a quella molecola. Buoni o cattivi che siano.
Benefici batteri intestinali residenti
Abbiamo già parlato del ruolo che il microbiota ha nei confronti della nostra salute mentale, del nostro umore, della nostra socialità. Un microbiota equilibrato comunica con il nostro organismo in modo da fornire sostegno energetico, nutritivo, ormonale ed ottenere in cambio cibo e protezione. Tuttavia fattori esterni (come terapie antibiotiche protratte per lungo tempo) o interni (come l’età avanzata) possono modificare questi equilibri e sostenere la crescita incontrollata di batteri infiammatori. Tutto questo a discapito di quei batteri che, come degli ambasciatori, tentavano di favorire la civile convivenza tra microbiota e ospite. Batteri come le Lachnospiraceae, F. prausnitzii, A. muciniphila, i Bifidobatteri e i Lattobacilli, sono degli ambasciatori intestinali e in presenza di patologie infiammatorie o terapie antibiotiche purtroppo tendono a diminuire.
Da pro-biotici a psico-biotici
Non è strano che questi ambasciatori benefici siano definiti probiotici (a favore della vita). Essi agiscono positivamente sul nostro organismo digerendo le molecole alimentari e trasformandole in composti antinfiammatori, energetici e immunostimolanti. Inoltre molti di questi probiotici sono coinvolti anche nella modulazione dell’asse intestino-cervello, nella regolazione dell’umore, nelle funzioni cognitive, nei processi di apprendimento e di memoria. Una loro forte diminuzione è stata vista in casi di patologie neurodegenerative (Alzheimer, Parkinson) oppure in caso di disordini mentali (depressione, autismo). Molti studi hanno riportato una correlazione tra assunzione prolungata di antibiotici, disbiosi, diminuzione di batteri probiotici e aumento di comportamenti simili a depressione o ansia.
Ma quindi se in queste patologie mancano determinati batteri, non potremmo reintegrarli? Ecco che da probiotici diventerebbero quasi dei farmaci per la mente: gli psicobiotici, appunto.
Medicina alternativa?
Non è un caso se, in concomitanza con una terapia antibiotica, sia consigliata l’assunzione di probiotici, anche in seguito alla conclusione della terapia stessa. In questo modo si favorisce la ricolonizzazione dell’intestino con batteri probiotici che a loro volta stimolano la crescita di altri batteri benefici. Lo stesso concetto di integrazione è stato applicato in vari studi di neuropsicologia, anche se ancora maggiormente su topi.
Ad esempio Lactobacillus plantarum PS128 e Lactobacillus rhamnosus (JB-1) anche singolarmente evidenziano attività ansiolitiche, antidepressive. Bifidobacterium longum 1714 è anche antistress mentre Lactobacillus helveticus NS8 riduce le disfunzioni cognitive e così via.
Diverse mix di probiotici sono in fase di sperimentazione per patologie come Alzheimer, Parkinson, autismo, ADHD. La ricerca sta procedendo e molti studi si stanno spostando dai topi agli umani, pertanto in qualche tempo probabilmente potremo avere un nuovo scaffale in farmacia. O nel banco frigo, dato che diverse aziende produttrici di probiotici e alimenti si stanno già muovendo in tal senso.
Nuove prospettive partendo da dentro di noi
Il termine integrazione è molto incoraggiante ma spesso nasconde un punto focale: i nostri probiotici intestinali ce li abbiamo già e li dobbiamo allevare amorevolmente. Questo implica che il nostro comportamento, specialmente quello alimentare, deve fornire giornalmente ai nostri batteri benefici tutto l’occorrente per proliferare al meglio.
La seguente tabella è una parte dell’analisi EVO di una persona che, pur non prendendo probiotici, ha nel suo intestino un’alta varietà di batteri benefici.
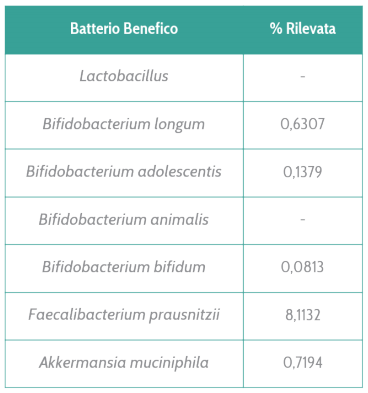
Batteri probiotici possono naturalmente essere presenti nell’intestino. A. muciniphila e F. prausnitzii sono i più comuni mentre i Bifidobatteri sono più presenti nei bambini o in caso di assunzione di probiotici integratori.
Dieta, movimento e stile di vita salutare saranno fondamentali per non perderli.
E voi, che batteri benefici avete?
Per chi volesse scoprirlo diamo un coupon con il 20% di sconto* sull’analisi di Microbioma Italiano, sia Evo che base: ev20-2204-1548.
Alla prossima!
Eleonora Sattin, PhD
Responsabile servizio Microbioma Italiano di BMR Genomics
*valido fino al 31/05/2020
Psychobiotics in mental health, neurodegenerative and neurodevelopmental disorders.
The Microbiome and Host Behavior.
Gut-Brain Psychology: Rethinking Psychology From the Microbiota–Gut–Brain Axis



