Psoriasi: lo squilibrio dell’asse intestino-pelle

“Puliti dentro, belli fuori.” recita una nota pubblicità. Probabilmente gli autori di questo slogan non potevano immaginare che la scienza del microbiota avrebbe dato loro ragione, ovviamente mutatis mutandis.
C’è un forte legame tra dentro e fuori
Il microbiota intestinale non è un tessuto a sé stante che controlla solo la funzionalità di se stesso e degli organi in cui vive ma influenza anche altre parti del corpo umano. Infatti lo abbiamo visto interagire con il cervello (asse intestino-cervello), oppure intervenire in patologie sistemiche come il diabete: perché non potrebbe influire anche su uno dei tessuti più visibili del nostro corpo ovvero la pelle?
Eppure sembrerebbero così distanti.. In realtà non è così: il microbiota intestinale produce svariate molecole segnale che intervengono ad ampio spettro sul benessere della pelle. Infatti i nostri abitanti intestinali regolano, tra le altre cose, anche il sistema immunitario sottocutaneo, la proliferazione delle cellule della pelle (i cheratinociti), e la rigenerazione cellulare e tissutale ad esempio dopo una ferita. Pertanto, in un certo senso, se siamo “belli dentro” (= in eubiosi o equilibrio intestinale) molto probabilmente siamo anche “belli fuori” (= in omeostasi tissutale, la pelle funziona correttamente). In altre parole siamo di fronte all’equilibrio dell’asse intestino-pelle.
E se l’equilibrio si rompe?
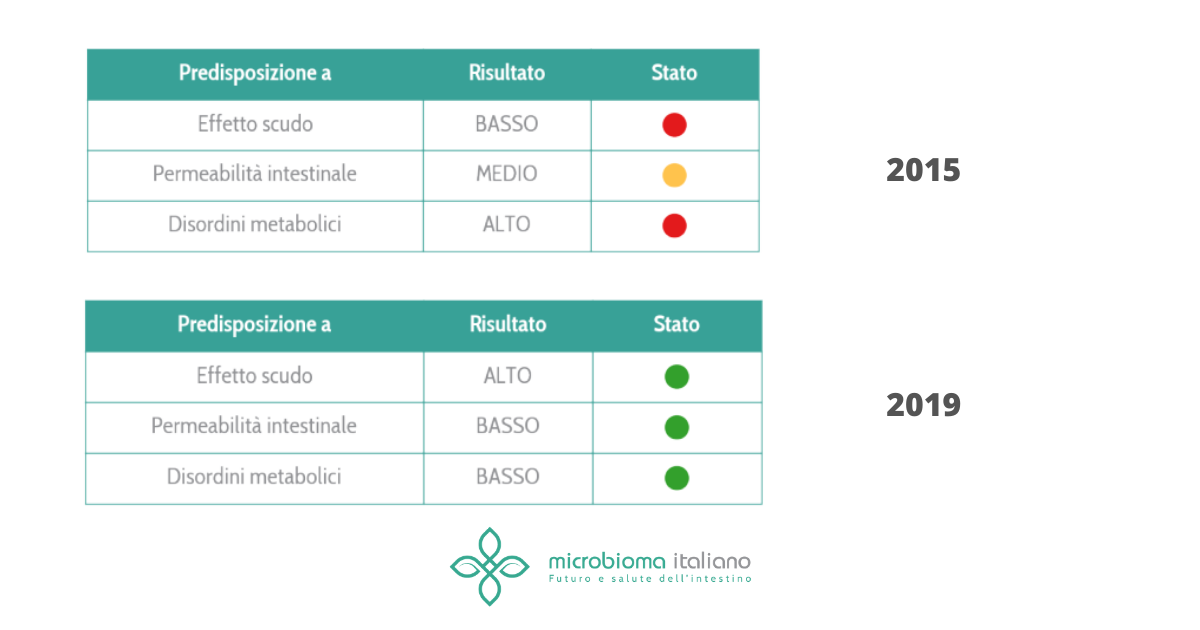
Molte patologie sistemiche o autoimmuni presentano uno stato di squilibrio intestinale che si auto alimenta in un circolo vizioso di disbiosi, infiammazione e distruzione della barriera intestinale in cui causa ed effetto sono spesso sovrapposte. E’ la barriera intestinale danneggiata che induce infiammazione e disbiosi o viceversa? Un po’ entrambe. Ad ogni modo tale condizione favorisce il passaggio di molecole infiammatorie batteriche nel sangue che, nel suo percorso, arriva anche al derma.
Nelle persone predisposte, questo accumulo di segnali “intestinali” induce le cellule immunitarie sottocutanee a produrre molecole infiammatorie che attivano i cheratinociti a proliferare esageratamente. Questo causa ispessimento della pelle che può rompersi per motivi meccanici. Il microbiota della pelle a questo punto diventa fondamentale perché la sua composizione può influenzare positivamente o negativamente la guarigione della lesione.
La psoriasi è una patologia da “esposoma”
Quanto descritto sopra è il tipico scenario che accade nella psoriasi, una dermatosi cronica infiammatoria mediata dal sistema immunitario che dipende da moltissimi fattori interni ed esterni (esposoma). Genetica, stile di vita, alcuni medicinali, obesità, fumo, infezioni, stress, sembrano essere fortemente correlati all’insorgenza della patologia. Si presenta con chiazze di pelle ispessita e soggetta ad una forte desquamazione, fino a provocare lesioni cutanee.
In molti casi la psoriasi è diagnosticata insieme ad altre patologie che sono anch’esse collegate con una modulazione sbilanciata del sistema immunitario, un livello esagerato di infiammazione sistemica e disbiosi con danno alla barriera intestinale. Infatti ad esempio il 7%-11% di persone con IBD ha diagnosi di psoriasi e spesso obesità, ipertensione o diabete di tipo 2 dimostrano comorbidità con la psoriasi.
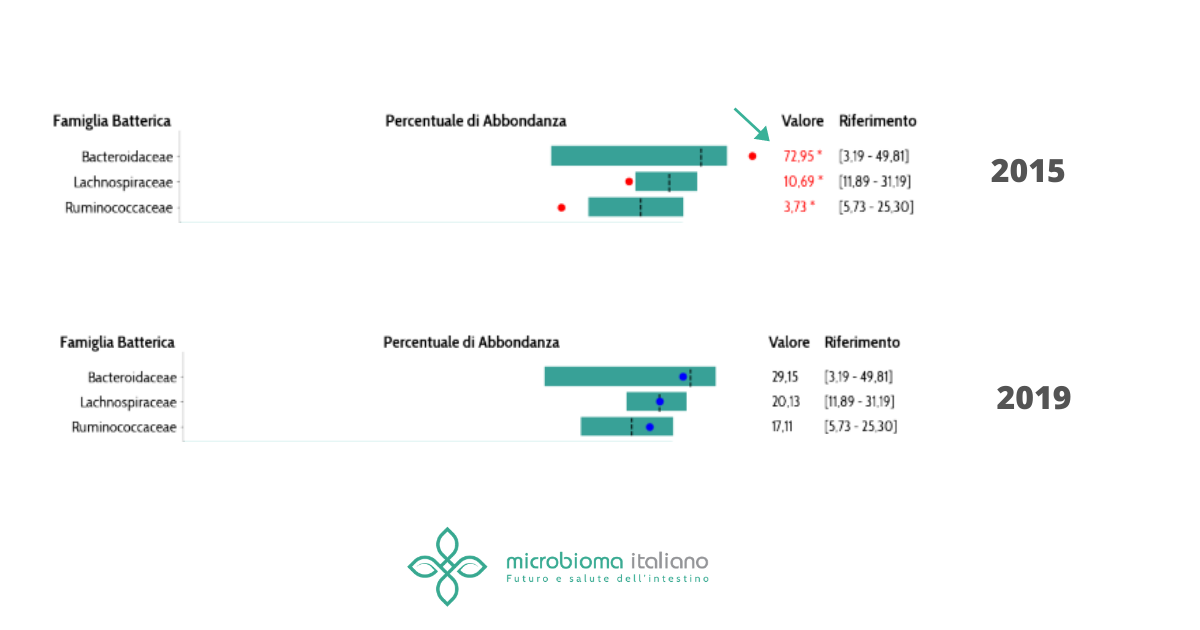
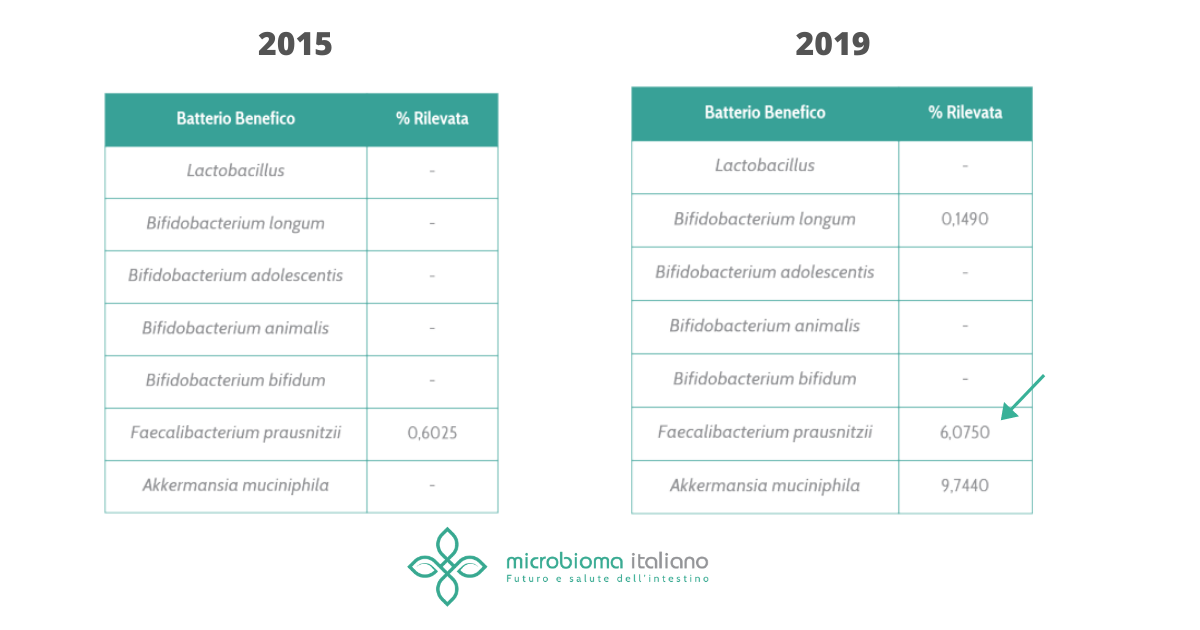
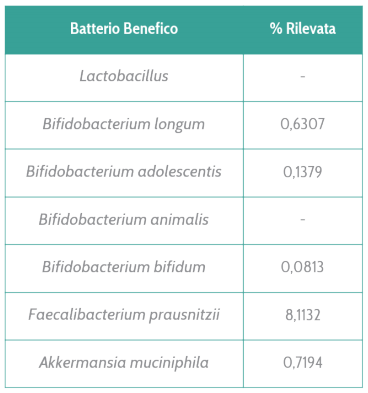
In tutte queste patologie il tipo di disbiosi è un po’ diverso e spesso non sempre chiaro tra i diversi studi, tuttavia ciò che è noto è in tali patologie alcuni batteri probiotici e benefici tendono a diminuire. Uno su tutti il Faecalibacterium prausnitzii, che produce molecole antinfiammatorie e regolatorie per il sistema immunitario, è tipicamente impoverito.
Curare l’intestino per curare la pelle?
Antibiotici, probiotici, trapianto fecale sono in test per migliorare la patologia utilizzando come target l’intestino. Ad esempio, diversi studi hanno testato l’efficacia di alcuni probiotici sul riequilibrio dell’asse intestino-pelle, come il Bifidobacterium infantis 35,624 e il Lactobacillus pentosus GMNL-77 che hanno ridotto i livelli di infiammazione sistemica e attenuato i sintomi della psoriasi. Nondimeno il trapianto fecale, come per l’IBD, è una strategia che sembra molto promettente per abbassare l’infiammazione sistemica.
E che dire dell’alimentazione? Sappiamo che è uno degli strumenti più comuni a disposizione per contrastare la disbiosi e l’infiammazione. Non a caso, tra le altre, la dieta mediterranea ricca in antiossidanti, omega-3, vitamine ed oligoelementi è un ottimo coadiuvante nella terapia di una patologia infiammatoria sistemica come la psoriasi.
Forse un po’ lo potevamo immaginare?! 😉
Alla prossima!
Eleonora Sattin, PhD
Atiya Rungjang et al. (2020). Skin and Gut Microbiota in Psoriasis: A Systematic Review
Mariusz Sikora et al (2020). Gut Microbiome in Psoriasis: An Updated Review. Pathogens